Nuevas aplicaciones de los polímeros conductores
RESUMEN
En este artículo se describe el desarrollo de dos de las más novedosas aplicaciones prácticas de los polímeros conductores, ambas basadas en su estructura molecular orgánica combinada con su inusual conductividad eléctrica y su elevada capacidad de almacenamiento de carga. Se han empleado polímeros conductores como aditivos en forma de núcleos dispersos en pinturas anticorrosivas, y se ha verificado un aumento de la protección del acero frente a su corrosión en el medio marino. Dentro de otro campo de aplicación, se ha estudiado la capacidad de films de polímeros conductores para enlazar con cadenas proteicas, actuando como soporte de monocapas celulares. Se ha ensayado su adherencia, su biocompatibilidad y su electrocompatibilidad, parámetros aplicables a la preparación de componentes de biosensores e, incluso, al desarrollo de piezas de implantes anatómicos.
Encargado: 20 de octubre de 2010
Recibido: 14 de diciembre de 2010
Aceptado: 22 de diciembre de 2010
Palabras clave
Polímeros conductores, electroactividad, corrosión, biocompatibilidad
ABSTRACT
This article describes the development of two of the newest applications of conductive polymers, both based on organic molecular structure combined with its unusual electrical conductivity and high charge storage capacity. Conducting polymers have been used as additives in the form as scattered nuclei in anti-corrosive paints, and a increase in its capacity of protection of steel in the marine environment has been verified. In another field of application, we studied the ability of films for conducting polymers to bind to protein chains, acting as a support for cell monolayers. Cellular adhesion, biocompatibility and electrocompatibility have been assayed. These parameters are applicable to the preparation of components of biosensors, including the development of parts of anatomical implants.
Commissioned: October 20, 2010
Received: December 14, 2010
Accepted: December 22, 2010
Keywords
Conducting polymers, electroactivity, corrosion, biocompatibility
Propiedades eléctricas de los polímeros conductores
Generalidades
Los polímeros conductores son materiales orgánicos con largas cadenas conjugadas, que tienen una distribución de dobles enlaces C=C alternándose con enlaces simples C-C, y poseen aniones dopantes incorporados a la cadena. Estos aniones estabilizan su estructura conjugada, disminuyen la deslocalización electrónica (les confieren estructura salina) y incrementan varios órdenes de magnitud su conductividad eléctrica (Groenendaal 2000, Scrosati 1993, Brillas et al 2000, Nalwa 1997, Oliver et al 2006). Son conocidas sus propiedades electroquímicas, electrocrómicas y electroquimiomecánicas (Alemán 2005, Nalwa 1997, Chandrasekhar 1999, Fernandez Otero 2003) y es especialmente destacable su capacidad de almacenamiento de carga, es decir, la carga que puede ser almacenada por la unidad de masa del polímero (Fernández Otero 2003, Nalwa 1997, Estrany 2007), que orienta su aplicación a la protección de la corrosión metálica (Wei et al 1995, Kousik et al 2001, Ocampo et al 2005, Irribarren et al 2005).
Conductividad eléctrica y polímeros conductores
La conductividad eléctrica es la capacidad que tiene un material de dejar pasar la corriente eléctrica a través de él, y sus unidades son siemens/centímetro (S/cm). La teoría de las bandas (Nalwa 1997, Scrosati 1993, Fernández Otero 2003) explica la conductividad basándose en el concepto de «distancia entre capas electrónicas», es decir, el espacio simbólico que hay entre la capa más energética ocupada por electrones (banda de valencia) y la capa menos energética libre (banda de conducción). La conductividad del material a escala molecular depende de la facilidad que tengan los electrones de saltar entre dichas capas. En los metales estas dos bandas se solapan, en los materiales semiconductores están cercanas y en los materiales aislantes están muy separadas. En el caso de los polímeros conductores, el «eslabón» que facilita el transporte de carga a través de sus cadenas son los polarones y bipolarones. Un polarón es un catiónradical parcialmente deslocalizado en varias unidades monoméricas, mientras que un bipolarón es un dicatión diradical (figura 1).
Monómeros más estudiados. Heterociclos
Los polímeros generados electroquímicamente suelen estar formados por moléculas de compuestos aromáticos entre los que destacan los heterocíclicos. Un compuesto heterocíclico es una sustancia que contiene un anillo aromático formado por más de un tipo de átomos, además del carbono; los más comunes son N, O y S. Los compuestos heterocíclicos más simples de cinco átomos son: pirrol, furano y tiofeno, cada uno de los cuales sólo tiene un heteroátomo (Fernández Otero, 1994).
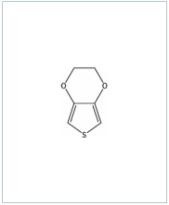
Los politiofenos alcoxisustituidos se dopan con más facilidad y son más estables en estado conductor que el politiofeno, debido a la propiedad liberadora de electrones del grupo alcoxi. La unión de las posiciones 3 y 4 con el grupo etilendioxi (en caso del etilendioxitiofeno, EDOT, figura 2) produce polímeros estables con una gran conductividad, del orden de entre 200 y 300 S/cm, el más conocido de los cuales es el polietilendioxitiofeno (PEDOT) (Fahlman et al 2003, Heywang y Jonas 1992, Dietrich et al 1994, Ocampo et al 2006).
El PEDOT destaca por sus buenas propiedades eléctricas y electroactivas, así como por su alta estabilidad temporal, factor que lo hace técnicamente interesante para aplicaciones en recubrimientos. En el grupo de investigación IMEM, del Departamento de Ingeniería Química de la UPC, se han ensayado distintos copolímeros y compuestos derivados del PEDOT combinado con poli(3-metiltiofeno), o 3MT, y también con poli(N-metilpirrol), o PNMePy, (Oliver et al 2006 y Ocampo et al. 2007a), con el objetivo de encontrar materiales idóneos para ser aplicados en la protección contra la corrosión del acero. Por otra parte, las cadenas de PEDOT tienen la propiedad de enlazarse con cadenas de aminoácidos, como en el caso del ADN, propiedad que se viene explorando debido a su interesante aplicación como sustrato de soporte celular (Ocampo et al 2007b y Del Valle et al 2007.).
El fenómeno de la corrosión
La corrosión del acero en agua de mar
La corrosión marina, como todo fenómeno en soluciones acuosas, es un proceso de naturaleza electroquímica. Se entiende por corrosión la interacción de un metal con el medio que lo rodea, produciendo el deterioro de sus propiedades tanto físicas como químicas. Este fenómeno sólo ocurre en presencia de un electrolito, y aparecen dos regiones plenamente identificadas, llamadas anódica y catódica. En el ánodo se produce una reacción de oxidación, en la que los electrones son liberados y se dirigen a la región catódica. Por tanto, en la reacción anódica se produce el ataque al metal (corrosión). Según los efectos producidos se puede distinguir básicamente tres tipos: la corrosión uniforme, la corrosión localizada y la corrosión intergranular. La localizada que se produce en el acero cuando se encuentra en medio salino es un fenómeno muy característico de las costas, y es la que se abordará en este estudio. Uno de los ejemplos más destacable es la corrosión producida en los cas-cos de los buques. El electrolito corrosivo por excelencia de la naturaleza es el agua de mar. En ella se mantiene en todo momento un contacto eléctrico entre las posibles regiones anódicas y catódicas. El anión cloruro, Cl–, de pequeño volumen iónico, es capaz de penetrar en el casco del buque, agrietándolo, pasando posteriormente a la red metálica, iniciando y activando túneles de corrosión. El oxígeno disuelto en el agua desempeña un papel principal, ya que suministra la especie necesaria para que se produzca la reacción catódica. La temperatura del agua del mar varía en función de la estación del año y del lugar, pero oscila entre -2 ºC y 35 ºC. En general, la velocidad de corrosión del acero en el medio salino es proporcional a la temperatura.
Métodos de protección de la corrosión
Actualmente, pueden emplearse diferentes técnicas destinadas a prevenir la corrosión metálica, como son: la aplicación de recubrimientos metálicos y no metálicos, la utilización de inhibidores y pasivadores, protección catódica o anódica y el empleo de aleaciones con propiedades autoprotectoras. En la protección por recubrimientos no metálicos se distinguen los siguientes métodos: fosfatación, oxidación superficial, esmaltado y pinturas. La aplicación de polímeros conductores en la protección contra la corrosión se enmarca en el campo de los recubrimientos no metálicos y en el campo de la protección anódica.
La protección anódica consiste en la formación de películas protectoras en la superficie de los metales, de igual modo que en la oxidación se forman películas de óxido autoprotectoras de forma natural. La técnica consiste en añadir un ánodo cuyo potencial de reducción sea mucho menor que el del elemento que se ha de proteger. Entonces, por efecto de pila galvánica, se protege dicho elemento, al destruirse el ánodo añadido (que se sacrifica). Los ejemplos más comunes son el uso de cinc en galvanizados, en pinturas, o de magnesio en calderas de agua dulce, para la protección del acero o del acero revestido.
La aplicación de revestimientos de pintura es el método más utilizado en la protección contra la corrosión metálica, por su acción impermeabilizante e inhibidora de los procesos oxidativos. Actualmente, en el 80-90% de las superficies que se pretende proteger se utilizan pinturas. La pintura suele ser una mezcla de un líquido (vehículo) con uno o varios colorantes (pigmentos). El vehículo está compuesto por un disolvente y un ligante (resina), responsable de las propiedades de aplicación, tiempo de secado, propiedades mecánicas, etcétera.
Mecanismo de protección anódica promovida por la electroactividad de los polímeros conductores
Una de las propiedades de los polímeros conductores que les convierte en materiales potencialmente aplicables como protectores contra la corrosión es su capacidad de almacenamiento de carga. El material es electroactivo cuando puede incorporar una cierta cantidad de carga positiva en el proceso de oxidación y liberar dicha carga en el proceso de reducción. De este modo, el material absorbe la carga que corroería al metal, en un proceso de protección anódica. El PEDOT electrogenerado presenta alta conductividad y muy buenas propiedades electroactivas que han sido avaladas por numerosos trabajos de investigación (Jonas et al 1995, Heywang et al 1992, Ocampo et al 2005, Liesa et al 2006, Iribarren et al 2005, Armelin et al 2007).
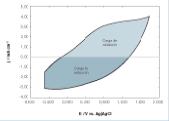
Se puede comprobar la capacidad redox del PEDOT en un voltamperograma de control, como el de la figura 3, obtenido al someter films de una especie sobredopada de PEDOT a procesos de oxidación y reducción (Heywang G). En el eje de ordenadas de la figura 3 se representa la densidad de corriente que atraviesa el material, y en el eje de abscisas el potencial al que se va sometiendo el polímero a la velocidad de 100 mV·s-1. Además, el material tiene una elevada estabilidad electroquímica; el ciclo de oxidación-reducción de la figura 3 puede desarrollarse repetidas veces sin que el material pierda su capacidad de almacenamiento de carga.
Figura 3. Voltametría cíclica de control para una muestra de PEDOT dopada con iones perclorato (Heywang, 1992).
Compuestos multicapa de polímeros conductores
Electroactividad de los compuestos multicapa
Recientemente, se ha preparado una serie de sistemas compuestos de films superpuestos, denominados multicapas, a partir de dos polímeros conductores distintos (figura 4).
La generación electroquímica se realiza capa a capa. Se trabaja con dos celdas electrolíticas, cada una con el medio de generación correspondiente a uno de los dos homopolímeros, alternando adecuadamente la inmersión del electrodo en cada una de las celdas que contienen la disolución de cada monómero.
Comparando las curvas de voltamperometría cíclica del PEDOT y del poli-PNMePy solapadas, se puede observar que el primero es, con diferencia, el más electroactivo (figura 5, curva 1). Las áreas de oxidación y reducción son mucho más grandes en el caso del PEDOT (curva 1) que en el caso del poli(NMePy) (curva 2). Los voltamperogramas de control fueron llevados a cabo en un rango de -0,500 V a 1,600 V y a una velocidad de 100 mV s-1.
El comportamiento electroquímico de las multicapas es muy interesante. Se ha comprobado que el área de oxidación y reducción de los voltamperogramas de control, que define la electroactividad del material compuesto, es notablemente mayor que la suma de las áreas de los voltamperogramas de los films monocapa de cada uno de los homopolímeros que lo integran. La figura 6 muestra los voltamperogramas de control obtenidos al oxidar desde -0,500 V hasta 1,600 V, films de PEDOT puro (a), de tres capas alternadas PEDOTpoli(NMePy)-PEDOT (b), de cinco capas alternadas (c) y de siete capas (d). En todos los casos, la masa final de polímero en los electrodos fue muy similar, entre 1,2 y 1,4 mg·cm-2, diferenciándose básicamente en el número de capas de polímero alternadas.
En la figura 6 puede verse muy claramente el incremento del área de oxidación y reducción, conforme va aumentando el número de capas. Es decir, las multicapas compuestas por PEDOT-PNMePy-PEDOT de tres, cinco o siete films superpuestos, son mucho más electroactivas que un film compuesto de un único tipo de polímero, y en este caso se ha comparado con el PEDOT, que presenta una excelente electroactividad.
Cabe destacar también que el incremento marginal de electroactividad al pasar de cinco a siete capas es pequeño. Por ello, se han elegido los materiales compuestos de tres y cinco capas para realizar los ensayos de corrosión empleando polímeros multicapas como aditivos anticorrosivos en pinturas (apartado 5).
Micromorfología superficial de las multicapas de polímeros conductores
La figura 7a muestra la fotografía, obtenida a 30.000 aumentos con un microscopio electrónico de barrido (SEM), de la superficie de un film de PEDOT puro electrodepositado sobre el electrodo de acero empleando un potencial de 1,400 V durante 300 s, mientras que la figura 7b muestra la fotografía SEM de la superficie de un film compuesto de tres capas de polímeros (multicapa 3). En ambas micrografías se puede apreciar un notable grado de rugosidad de la superficie a escala microscópica.
Tanto la figura 7a como la 7b muestran una superficie muy rugosa a nanoescala, pero es de destacar que en la figura 7b se aprecia que la superficie de la multicapa es aún más irregular que la de la capa simple, presenta mayores desniveles y una mayor proporción de núcleos aglomerados en la parte superior que la superficie del homopolímero puro PEDOT, con lo que en la superficie de la multicapa quedan mejor definidos los espacios intersticiales, Esto significa que el tamaño de poro es mayor en el film compuesto de tres capas respecto al del de PEDOT monocapa. Este resultado cualitativo es coherente con la mayor electroactividad de las multicapas respecto al PEDOT y apoya la hipótesis de que la movilidad de los aniones a través de la interfase es el factor que controla su incorporación al polímero.
Ensayos de protección de la corrosión
Dispersión de los polímeros multicapa en la pintura
La estrategia prevista para estudiar la protección de la corrosión metálica se basa en formar una dispersión de micropartículas de polímero conductor en una pintura anticorrosiva. Estas micropartículas constituyen elementos de almacenamiento de carga que absorben la corriente de oxidación que corroería el metal. Es decir, actuarán como ánodos de sacrificio, pero de modo uniforme y extendido a toda la superficie. Para conseguir la máxima dispersión de las partículas en el seno de la pintura se ha molturado previamente el material en un mortero de ágata. La pintura se prepara con cuatro partes de resina por una de endurecedor, y después se dispersa el polímero finamente molido en una pequeña parte de pintura. Una vez conseguida la dispersión total del polímero se mezcla la parte de pintura que contiene el polímero con el resto de la pintura, agitando toda la masa de forma que la dispersión quede homogénea. La dosificación del polímero es del 0,1% en peso. Las fotografías de la figura 8 muestran la superficie de dos de las preparaciones de polímeros multicapa con una ampliación de cinco aumentos, y se observa que la suspensión es aceptablemente regular. Además, se han efectuado ensayos previos de verificación visual de la compatibilidad física de trozos de film del material ensayado con la pintura. Se aprecia que la pintura de base epoxi tiende a recubrir a las láminas de los polímeros conductores con mucha facilidad.
Preparación de las probetas para los ensayos de resistencia a la corrosión
Las probetas son de acero de bajo contenido en carbono y laminado en frío, con una rugosidad media de 1,90 mm. Sus dimensiones son, aproximadamente, de 48 mm x 40 mm x 23 mm. Cada chapa metálica se ha recubierto con dos capas de pintura, dejando un periodo de secado entre cada aplicación de 15 minutos. La capa final de pintura es de 0,2 mm de espesor. Las probetas recubiertas de pintura (figura 9a) han sido sometidas a ciclos de inmersión en soluciones salinas con posterior escurrido y secado, en un robot simulador que tiene programados los tiempos de cada operación (figura 9b).
Resultados de los ensayos de corrosión
Las probetas recubiertas de pintura anticorrosiva han sido sometidas a ensayos acelerados de simulación de corrosión por agua de mar y ambiente marino, consistentes en ciclos de inmersión y secado de forma ininterrumpida durante cuatro semanas. Se les ha practicado un corte en forma de aspa para asegurar el contacto del agua salobre con el metal, simulando así las condiciones lo más adversas posible sobre el casco de un buque (rayado de la pintura debido a golpes y rozaduras con rocas, etcétera).
Determinación del grado de corrosión por la medida del área corroída
Al extraer las probetas, éstas son sometidas a un proceso de rascado de la pintura para verificar su grado de adherencia, y medir la superficie corroída en la zona en la que ha saltado la pintura. La figura 10 muestra el aspecto de las pro-betas una vez que han sido sometidas al rascado. Como puede observarse, la superficie afectada por la corrosión es menor en la probeta protegida por la pintura aditivada con los blends (figura 10b) que la de la pintura sin aditivar (figura 10a).
El ensayo de pérdida de adherencia se ha efectuado siguiendo la norma ASTMD1654-79a. Se determina la pérdida de adherencia de la pintura midiendo las dimensiones de la zona que queda sin pintura al raspar la superficie de las pro-betas. El grado de corrosión se cuantifica midiendo la superficie corroída en la zona mencionada.
Grado de corrosión
La figura 11 muestra los resultados de un estudio de comparación de las superficies de las probetas afectadas por la corrosión en las probetas una vez que son retiradas del robot simulador y después de aplicar el rascado (Aradilla et al 2007). Las gráficas demuestran que la presencia de multicapas de polímero conductor en la pintura tiene un notable efecto inhibidor de la corrosión localizada en la zona de las aspas. Se observa un comportamiento muy semejante entre las pinturas aditivadas con los dos tipos de multicapa.
Ensayos de adhesión celular sobre un polímero conductor
Preparación del sustrato
Como sustrato para el recubrimiento celular se ha ensayado el PEDOT (Del Valle et al 2007) y copolímeros de EDOT y 3-metiltiofeno (Ocampo et al 2007b). Los films de PEDOT, cuyos resultados se exponen a continuación, se han obtenido por cronoamperometría aplicando un escalón de potencial de 0 a 1,400 V durante 300 s a una disolución 10 mM del monómero en acetonitrilo, con una concentración 0,1 M de LiClO4 que actúa como agente dopante. El polímero se ha depositado sobre placas cuadradas de acero inoxidable de 1 cm de lado, que es el tamaño adecuado para que puedan disponerse dentro de los compartimentos de cultivo, que se puede ver en la figura 12. Una vez recubiertas de polímero, las placas han sido sometidas a un proceso de esterilización mediante radiación UV.
Preparación de la población de células
Se ha preparado un cultivo de células de cáncer de laringe, que son de tipo eucariota y que se desarrollan con rapidez. El medio utilizado para hacer crecer las colonias celulares ha sido el Dulbecco’s modified Eagle medium (o DMEM), complementado con suero, antibióticos, aminoácidos y sales. Se ha trabajado en una atmósfera de aire a 37 ºC con el 5,1% de CO2.
Las células se han separado a partir de un cultivo inicial con DMEM, y se han contabilizado gracias a la adición de un colorante vital denominado azul de tripano, en solución al 0,4%, y el posterior conteo en una cámara de Newbauer. En el proceso de extracción de las células de su cultivo original, que se realiza con una proteasa denominada trixina, es necesario utilizar una disolución tampón de fosfato potásico (PBS) para bloquear reacciones de envenenamiento celular. La disolución PBS también se ha empleado para lavar las placas con polímero conductor al extraerlas del medio después de la adhesión celular.
Medida de la adhesión celular
En las cubetas se ha introducido la cantidad necesaria de líquido para contener un total de 5 x 104 células, el cual se ha puesto en contacto con las placas que contienen polímero conductor. A las 24 h y a las 72 h se ha realizado la verificación del crecimiento de las células sobre las muestras de polímero, sobre placas de acero inoxidable (ensayo en blanco) y sobre una placa de poliestireno estándar con matriz celular, como ensayo de control. La medida del crecimiento celular se ha realizado aplicando el ensayo del MTT (bromuro de 3-(4,5-dimetiltiazol-2-il)-2,5 difeniltetrazolio), basado en la formación de una sal de formazán con la enzima proteasa, contenida en las células (Mosmann T, 1984), cuya concentración en el medio se determina por colorimetría y es directamente proporcional al número de células en la cubeta. La absorbancia medida, denominada viabilidad de las células, se refiere a mm2 de superficie.
Las figuras 13a y 13b muestran los resultados de la adhesión de las células sobre el PEDOT, respectivamente, a las 24 h y a las 72 h, respectivamente, de iniciado el cultivo. En la figura 13a se observa la buena adherencia de las células al sustrato polimérico, muy superior a la del acero y similar a la de la placa de poliestireno (control). Este resultado es interesante debido a que la placa de control lleva matriz celular y, por tanto, su superficie se asemeja a la de un tejido orgánico.
Otro hecho destacable es que en el momento de la proliferación las células en el sustrato polimérico han ocupado mayoritariamente toda la superficie mientras que en el acero no. De de ello se deriva el notable crecimiento de las células en la placa de acero al cabo de las 72 horas, debido a la mayor presencia de superficie libre.
Micromorfología superficial del polímero conductor con células adheridas
Para la verificación visual de la adhesión celular se han realizado fotografías SEM en muestras de PEDOT sólo y con células adheridas. Previamente, las monocapas celulares fueron deshidratadas y recubiertas con grafito en polvo para asegurar su respuesta al haz electrónico.
La figura 14a muestra la superficie del PEDOT sin células aumentada 20.000 veces. En ella puede verse que a este aumento presenta un relieve muy irregular. La figura 14b muestra una de las células de tejido epitelial que forman la monocapa que recubre el polímero.
Puede apreciarse un abundante número de filópodos que parten de la parte central de la célula y forman uniones entre los huecos de la superficie del material.
Electroactividad del PEDOT recubierto de células
La medida de la electroactividad de los films de PEDOT recubierto de células proporciona una información muy importante para determinar la compatibilidad electroquímica de la monocapa celular respecto al polímero conductor, de cara a sus aplicaciones biotecnológicas.
Al tratarse de un material compuesto que contiene materia viva, los voltamperogramas de control no se han podido realizar en acetonitrilo con LiClO4, que es el disolvente habitualmente empleado para estos materiales. En su lugar, el electrodo recubierto de polímero conductor se ha sumergido en una celda con un medio biológicamente favorable: se ha empleado el medio DMEM, en el que se ha hecho crecer las células y que contiene nutrientes y aminoácidos y el medio PBS, que es una disolución tampón empleada para la estabilización y los lavados de las células, también anteriormente mencionada.
Todos los films han sido oxidados desde -0,500 V hasta 1,600 V, que es el rango de potencial en que el PEDOT presenta una clara electroactividad en medio acetonitrilo con LiClO4 0,1 M (C. Ocampo et al 2005b, Armelin et al 2007, Oliver et al 2006, Aradilla et al 2007). La figura 15a muestra los voltamperogramas de control en el medio PBS del PEDOT (1), del PEDOT recubierto de la monocapa celular (2) y de la monocapa celular sola sobre el acero (3). La figura 15b muestra los voltamperogramas correspondientes al medio DMEM. En primer lugar, se observa que en el medio PSB la electroactividad del PEDOT (figura 15a-1) es casi igual que la que se obtuvo en trabajos anteriores, mientras que en el medio DMEM (figura 15b-1) se detecta un incremento notable de la densidad de corriente anódica, y una pendiente del pico de oxidación más pronunciada que en el voltamperograma obtenido en el medio PSB.
Esta diferencia se ha interpretado por el hecho de que el DMEM es un medio que contiene una mezcla compleja de nutrientes, asimilable a un fluido biológico, y parece que alguno de estos nutrientes se incorpora al film, incrementando su capacidad de formación de polarones electroactivos y, por tanto, su capacidad de oxidación. En cambio el según se ha descrito en la preparación de la población de células.
PBS es una disolución tampón mucho más sencilla, que sólo aporta aniones al PEDOT siguiendo un proceso de dopado que es controlado por el barrido anódico.
Es muy importante destacar el efecto de la monocapa celular sobre el film de PEDOT: como se puede observar en los voltamperogramas de las figuras 15a-2 y 15b-2, la combinación células-PEDOT aumenta la capacidad de almacenamiento de carga del material, como refleja el aumento de las áreas de oxidación y reducción respecto a las de los voltamperogramas de control del PEDOT en los correspondientes medios. Curiosamente, dicho efecto es mucho más notable en el medio PSB que en el medio DMEM y, además, esto es coincidente con la electroactividad de la monocapa celular, que es mucho mayor en el medio PSB (figura 15a-3) que en el medio DMEM (figura 15b-3). Parece ser que el efecto tamponador del pH del medio PSB proporciona a las células vivas un entorno lo suficientemente estable como para reaccionar ante el barrido anódico e incorporar aniones a través de sus membranas, mientras que el medio DMEM no les facilita dicha estabilidad iónica, y la monocapa apenas reacciona ante el estímulo eléctrico. En resumen, la voltamperometría cíclica demuestra la electrocompatibilidad entre la monocapa celular y el film de PEDOT, siendo la magnitud de este efecto claramente dependiente del medio en el que se realiza el voltamperograma de control.
Los resultados expuestos indican que el PEDOT tiene una buena afinidad por las monocapas celulares y que este recubrimiento biológico es electrocompatible con el polímero en cuanto a la capacidad de almacenamiento de carga. Esto hace que el PEDOT sea un buen candidato para diversas aplicaciones biotecnológicas e incluso médicas, como componentes de transmisión eléctrica en piezas ortopédicas, músculos artificiales, y en la fabricación de biosensores.
Conclusiones
Los compuestos multicapa formados por films alternados de PEDOT y PNMePy maximizan la relación entre la electroactividad y la estabilidad electroquímica del conjunto. Su capacidad de almacenamiento de carga aumenta con el número de capas, habiéndose determinado como óptimos los compuestos de tres y cinco capas, para los que el incremento relativo de la electroactividad es el mayor. El aumento de electroactividad se ha relacionado con el incremento de superficie específica del material al superponer las capas de polímeros diferentes, lo que se ha verificado cualitativamente por microscopia SEM.
Con los compuestos multicapa 3 y 5 se aditivaron al 0,1% pinturas anticorrosivas de base epoxi, y se ha estudiado se efecto protector de la corrosión del acero en ambiente marino, realizando ensayos acelerados de corrosión en un robot automático durante 28 días. Se han ensayado probetas con pintura sin aditivar, con pintura aditivada con multicapa 3 y con multicapa 5. En todas ellas se ha practicado un corte en forma de aspa, para conseguir las condiciones lo más agresivas posible.
Todas las probetas una vez extraídas del robot han sido sometidas a raspado, y se ha medido la superficie afectada por la corrosión en la zona donde ha saltado la pintura. El efecto de la adición de las multicapas a la pintura de base epoxi ha resultado bueno, pues la superficie corroída es, con diferencia, mucho menor en las probetas de pintura con aditivo que en las probetas preparadas con pintura sola. Si bien no se han apreciado claras diferencias entre los resultados de cada una de las multicapas, se han confirmado las expectativas de que un material con una elevada electroactividad es un componente activo de recubrimientos protectores de la corrosión. Existe la ventaja adicional de que, al ser estructuras con propiedades redox reversibles, se puede estudiar la aplicación intermitente de potenciales negativos sobre la superficie protegida para conseguir, al menos en parte, la regeneración de la capacidad de almacenamiento de carga del polímero conductor, alargando así la vida útil protectora del recubrimiento.
En cuanto a los estudios de adhesión celular, se ha verificado que células de cáncer de laringe tienen una buena adherencia sobre el polímero conductor PEDOT, mejor que sobre el acero. Se ha realizado también la comprobación de la notable adhesión de las células a la superficie del polímero a escala microscópica, con fotografías SEM.
Se ha estudiado la electroactividad del PEDOT recubierto de una monocapa celular, comparándola con el PEDOT sin recubrimiento biológico, empleando los medios DMEM y PBS. Por un lado, se ha determinado que el PEDOT tiene mayor electroactividad en el medio DMEM, que es el que tiene una composición más compleja, con nutrientes biológicos que, al parecer, interactúan con el PEDOT y activan su capacidad de incorporación de cargas. Este es precisamente el efecto positivo que se ha observado en el PEDOT con recubrimiento celular: un claro incremento de la electroactvidad respecto al PEDOT sin células, efecto que ha sido más notable, obviamente, en el medio PBS, en el que la electroactividad del PEDOT sin recubrimiento celular es menor. Esta electrocompatibilidad entre el PEDOT y la monocapa celular lo hace candidato a diversas aplicaciones biotecnológicas e incluso médicas, como componentes de transmisión eléctrica en piezas ortopédicas, músculos artificiales, y en la fabricación de biosensores.
Agradecimientos
Los autores agradecen al Ministerio de Educación y Ciencia la financiación del Proyecto MAT2006-4029. También dedican un reconocimiento muy especial a David Aradilla Zapata, del grupo IMEM, por su contribución directa en muchos de los resultados que se han recogido en el presente artículo, y a Ramón Oliver Pujol, también del grupo IMEM, por sus aportaciones en distintas fases de los estudios que han sido expuestos.
Bibliografía
Alemán C, Oliver R, Brillas E et al (2005). A combined theoretical and experimental investigation about the influence of the dopant in the anionic electropolymerization of -tetrathiophene. Chem Phys 314: 1-7.
Alemán C, Oliver R, Brillas E et al (2006). A combined theoretical and experimental investigation about the influence of the dopant in the anodic electropolymerization of -tetrathiophene. Chem Phys 323: 407-12.
Aradilla D, Ocampo C, Armelin E et al (2007). Application of multilayered particles formed by poly(3,4ethylenedioxythiophene) and poly(n-methylpyrrole) as anti-corrosive additives of conventional organic coatings. Materials and Corrosion 58: 867-72.
Armelin E, Oliver R, Liesa F et al (2007). Marine paint formulations: conducting polymers as anticorrosive additives. Progress in Organic Coatings 59: 46-52.
Brillas E, Carrasco J, Oliver R. et al (2000). Electropolymerization of 2,5-di-(-2-thienyl)-pyrrole in ethanolic medium. effect of solution stirring on doping with perchlorate and chloride ions. Electrochim Acta 45: 4049-57.
Brillas E, Oliver R, Estrany F, Rodríguez E, Tejero S (2002). Anodic polymerization of -tetrathiophene in organic medium. doping with perchlorate ion and properties of conducting polymer. Electrochi. Acta 47: 1623-31.
Chandrasekhar P (1999). Conductimg Polymers, Fundamentals and Applications. A practical approach. Springer Netherlands. ISBN: 0792385640.
Del Valle LJ, Aradilla D, Oliver R et al (2007). Cellular adhesion and proliferation on poly(3,4-ethylenedioxythiophene): benefits in the electroactivity of the conducting polymer. European Polymer Journal 43: 2342-9.
Dietrich M, Heinze J, Heywang G et al (1994). Electrochemical and spectroscopic characterization of polyalkylenedioxythiophenes. J Electroanal Chem 369: 87-92.
Estrany F, Oliver R, García E et al (2003). Electrogeneration of conducting poly( lpha-tetrathiophene). Effect of solution stirring and detection of linear oligomers. Collect Czech Chem Commun 68: 1326-44.
Estrany F, Oliver R, Cabot P L et al (2006). Effect of monomer molecular flow on electrode surface on the structure of poly( lpha-tetrathiophene) obtained by anodic polymerization. European Polymer Journal 42: 563-72.
Estrany F, Aradilla D, Oliver R et al (2007). Electroactivity, electrochemical stability and electrical conductivity of multilayered films containing poly(3,4-ethylendioxythiophene) and poly(nmethylpyrrole). European Polymer Journal 43: 1876-82.
Fahlman M, Groenendaal L, Schryver F et al (2003). Conductivity, morphology, interfacial chemistry, and stability of poly(3,4-ethylene dioxythiophene)- poly(styrene sulfonate): a photoelectron spectroscopy study. J Polym Sci: Polym Phys B. 41: 2561-83.
Fernández Otero T, Rodríguez J (1993). Kinetics of polypyrrole electrogeneration on Pt through tafel slopes. Synth Met 55: 1436-40.
Fernández Otero T, Rodríguez J (1994). Role of protons on the electrochemical polymerization of pyrrole from acetonitrile solutions. J Electroanal Chem 379: 513-6.
Fernández Otero T (2003). Polímeros conductores: síntesis, propiedades y aplicaciones electro-químicas. Revista iberoamericana de polímeros 4:1-37.
Grgur BN, Krstajic NV, Vojnovic MV et al (1998). The influence of polypyrrole films on the corrosion behavior of iron in acid sulfate solutions. J Prog Org Coat 33: 1-6.
Groenendaal B L, Jonas F, Freitag D et al (2000). Poly(3,4-ethylenedioxythiophene) and its derivatives: past, present, and future. Adv Mater 12: 481-94.
Heywang G, Jonas F (1992). Poly(alkylenedioxythiophene)s. New, very stable conducting polymers. Adv Mater 4: 116-8.
Iribarren JI, Cadena F, Liesa F (2005). Corrosion protection of carbon steel with thermoplastic coatings and alkyd resins containing polyaniline as conductive polymer. Prog Org Coat 52: 151-60.
Jonas F, Krafft E, Muys B (1995). Poly(3,4-ethylenedioxythiophene). Conductive coatings, technical applications and properties. Macromol Symp 100: 169-73.
Kousik G, Pitchumani S, Renganathan NG (2001). Electrochemical characterization of polythiophenecoated steel. Prog Org Coat 43: 286-91.
Liesa F, Ocampo C, Alemán C et al (2006). Application of electrochemically produced and oxidized poly(3,4-ethylenedioxythiophene) as anticorrosive additive for paints: influence of the doping level. Journal of Applied Polymer Science 102: 1592-9.
Mosmann T (1983). Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal Immunol Methods 65 (1-2): 55-63.
Nalwa HS (1997). Handbook of Organic Conductive Molecules and Polymers Ed. John Wiley & Sons Ltd., New York. ISBN: 0471965936.
Ocampo C, Armelin E, Liesa F et al (2005). Application of a polythiophene derivative as anticorrosive additive for paints. Prog Org Coatings 53: 217-24.
Ocampo C, Oliver R, Armelin E et al (2006). Eno accessEEEeelectrochemical synthesis of poly(3,4ethylenedioxythiophene) on steel electrodes: properties and characterization. Journal of Polymer Research 13: 193-200.
Ocampo C, Alemán C, Oliver R et al (2007a). Copolymers of N-methylpyrrole and 3,4-ethylenedioxythiophene: structural, physical and electronic properties. Polymer International 56: 803-9.
Ocampo C, Armelin E, Estrany F et al (2007b). Copolymers of 3,4-ethylenedioxythiophene and 3-methylthiophene: properties, applications and morphologies. Macromolecular Materials and Engineering 292: 85-94.
Oliver R, Muñoz A, Ocampo C et al (2006). Electrochemical characteristics of copolymers electrochemically synthesized from N-methylpyrrole and 3,4-ethylenedioxythiophene on steel electrodes: comparison with homopolymers. Chemical Phyisics 328: 299-306.
Pei Q, Zuccarello G, Ahlskog M et al (1994). Electrochromic and highly stable poly(3,4-ethylenedioxythiophene) switches between opaque blue-black and transparent sky blue. Polymer 35: 1347-51.
Scrosati B (1993). Application of Electroactive Polymers. Chapman and Hall. London. ISBN: 0412414309.
Timpanaro S, Kemerink M, Touwslager FJ et al (2004). Morphology and conductivity of PEDOT/PSS films studied by scanning-tunneling microscopy. Chem Phys Lett 394: 339-43.
Wei Y, Wang J, Jia X et al (1995). Polyaniline as corrosion protection coatings on cold rolled steel. Polymer 36: 4535-7.
Wessling, B (1994). Passivation of metals by coating with polyaniline: corrosion potential shift and morphological changes. Adv Mat 6: 226-8.