Eliminación del nitrógeno amoniacal en aguas residuales sanitarias
El objetivo de este tratamiento por aireación controlada es aumentar la capacidad oxidante del medio para inhibir la descomposición de la urea que genera el NH4+ en el agua residual
Antecedentes
La existencia de una excesiva concentración de nitrógeno amoniacal en las corrientes de aguas residuales industriales es bastante frecuente hoy en día. Su procedencia es principalmente de las aguas sanitarias de los aseos o lavabos, si bien en las inspecciones se determina como un parámetro del total de efluentes residuales de la industria en cuestión, y generalmente sobrepasa el límite de concentración de vertido permitido por la ley. Este problema afecta sobre todo a empresas cuyo proceso no genera aguas residuales, y con un volumen de entre 200 y 400 trabajadores. En este caso, su generación de aguas residuales sanitarias es importante, pero no suficientemente grande como para justificar la inversión de una depuradora de tratamiento específico de las aguas residuales, que, en el caso descrito, serían sanitarias en su gran mayoría.
Incluso en casos de grandes industrias pueden existir problemas a la hora de controlar el parámetro del nitrógeno amoniacal al final de la línea de conducción de las aguas residuales donde se toman las muestras para la inspección, y es por lo siguiente: las aguas residuales de proceso son tratadas previamente a su vertido, con procesos físicos, químicos, fisicoquímicos o biológicos, en función del tipo de contaminante que conlleve dicho proceso industrial. En cambio, las aguas residuales sanitarias que se unen a las de proceso una vez ya tratadas son las que producen un aumento en la concentración del nitrógeno amoniacal, ya que no tienen tratamiento específico previo, pues son simplemente aguas “fecales”, y se consideran en cierto modo “inocuas”. En resumen, para solucionar el problema de estas empresas, el objetivo es desarrollar un tratamiento sencillo, efectivo y asequible para situar el parámetro de la concentración de NH4+ dentro de la normativa vigente.
En un trabajo anterior, se ha estudiado a escala de laboratorio el efecto de distintos procedimientos y reactivos para eliminar la presencia de ión amonio en las aguas residuales sanitarias en industrias, básicamente intentando impedir el desarrollo de colonias bacterianas promotoras de las reacciones que forman el NH4+. En el presente trabajo, los auto-res se han centrado en determinar un procedimiento de aplicación sencilla que bloquee rápidamente la reacción, sin necesidad de añadir al medio reactivos complejos que, lejos de solucionar el problema, podían aumentar la carga contaminante del agua residual. El seguimiento de la concentración de NH4+ se ha realizado mediante un electrodo selectivo dicho catión.
Instalaciones típicas de aguas residuales en la industria
Normalmente las aguas residuales industriales y las aguas residuales sanitarias siguen canalizaciones diferentes, pero se unen antes de llegar a la arqueta de toma de muestras. La mayor parte de las veces el problema proviene de las aguas residuales sanitarias, puesto que son, junto con las aguas pluviales, las que llegan a la arqueta de toma de muestras sin ningún tratamiento previo, y contienen la mayor proporción de materia orgánica, entre la que está la urea disuelta. Los vertidos efectuados deben estar dentro de los parámetros que se señalan en la Ordenanza de Saneamiento vigente para cada población, y las industrias susceptibles de realizarlos deberán instalar una arqueta de registro para el control y toma de muestras de los vertidos, así como para la evaluación de los caudales vertidos.
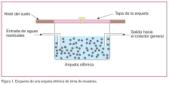
Los tubos de salida de las arquetas sifónicas de toma de muestra son de gres. Las paredes y suelo de los sótanos son impermeables, de forma que evitan en todo momento filtraciones. Las dimensiones de la arqueta son de 800 x 800 x 500 mm y debe estar instalada, a ser posible, inmediatamente aguas arriba del colector general (figura 1). Todos los vertidos van a parar a la arqueta por una sola tubería, y está distante como mínimo un metro de cualquier accidente, rejas, reducciones, codos, arquetas, etc, que puedan alterar el flujo normal de efluente. Su nivel de ocupación aproximado es de unos 300 litros. Las canalizaciones hasta la arqueta de toma de muestras suelen ser de una longitud de entre 50 a 70 metros con una inclinación adecuada para que no sea necesaria la utilización de ningún tipo de bomba que impulse las aguas a la arqueta. Se puede considerar que la proliferación del nitrógeno amoniacal se produce probablemente en este recorrido, y además en la propia arqueta de toma de muestras.
El tiempo de residencia medio de las aguas residuales en la arqueta, previo a la toma de muestras, es aproximadamente de unas 24-28 horas, estimadas considerando que en las tuberías puede haber alrededor de unos 2.000 litros que es, en promedio, el volumen de aguas residuales sanitarias que una empresa de las características indicadas en el apartado 1 puede llegar a generar diariamente.
La arqueta sifónica estará dotada de sifón, y arenero si es necesario. Está emplazada en una zona de fácil acceso, su tapa es practicable desde la zona de acceso y estará situada como máximo a dos metros de la línea de propiedad. La profundidad del tubo de salida de la arqueta sifónica, medida en la vía pública, en el paramento exterior de la finca, es de un 1,0 metros sobre rasante hidráulica como máximo.
En las arquetas de toma de muestras se dan una serie de circunstancias que pueden ser determinantes para la formación de nitrógeno amoniacal a partir de la urea procedente de las aguas residuales sanitarias. Algunas de las especificaciones son:
1. Agitación permanente en la parte superior de la arqueta sifónica.
2. Velocidad de flujo media (posibles zonas de estanquidad en la parte inferior).
3. Oscuridad (ausencia de luz natural directa).
4. Presencia de microorganismos producto de las aguas fecales.
5. pH alcalino (en la banda 7,0 – 9,0).
6. Probabilidad de anaerobiosis.
7. Todos los factores citados deben ser tenidos en cuenta a la hora de buscar un tratamiento para la eliminación del nitrógeno amoniacal en las aguas residuales.
Origen del nitrógeno amoniacal
El nitrógeno amoniacal se produce por descomposición de la urea, compuesto siempre presente en las aguas residuales sanitarias, por hidrólisis enzimática. Esta descomposición da como productos NH3 (amoníaco disuelto) y NH4+ (ión amonio). La hidrólisis es rápida, por lo que la urea raramente está presente en aguas residuales que no sean muy recientes. De hecho, la edad de un agua residual puede medirse en función de la proporción de amoníaco presente.
El amoníaco está en equilibrio con el anión amonio, en función del pH de la solución, de acuerdo con la ecuación (1):
NH3 + H2O ? NH4+ + OH– (1)
A niveles de pH superiores a 7, el equilibrio se desplaza hacia la izquierda, mientras que a valores de pH inferiores a 7 el NH4+ es predominante.
El nitrógeno amoniacal es entonces el resultado de la hidrólisis de la urea, según la ecuación química (2), así como de otras sustancias proteínicas presentes en el agua residual sanitaria.
(NH2)2CO + H2O ? CO2 + 2NH3 (2)
La hidrólisis de la urea se ve favorecida por un pH alcalino, entre 8,2 y 9,0, y el avance de la hidrólisis origina a su vez un aumento del pH del medio. Como se ha indicado, el proceso es rápido y produce una cantidad excesiva de amoníaco, que sobrepasa los requerimientos de los microorganismos para la síntesis proteica, con la consecuente pérdida de nitrógeno en el medio y posible peligro de toxicidad. Las aguas superficiales no deben contener amoníaco y, en general, la presencia de amoníaco libre o ión amonio es considerado como una prueba química de contaminación reciente y peligrosa.
Eliminación del nitrógeno amoniacal
Técnicas convencionales y estudios actuales
En medio aerobio, la acción de determinadas bacterias puede oxidar el nitrógeno amoniacal a nitritos y nitratos. La preponderancia del nitrógeno en forma de nitratos en un agua residual es un fiel indicador de que el residuo se ha estabilizado con respecto a la demanda de oxígeno. Y si el medio es aerobio, el nitrógeno amoniacal se transforma en nitritos. La eliminación de nitrógeno se basa en dos procesos combinados de nitrificación y desnitrificación1 , que conllevan una producción de fango en forma de biomasa fácilmente separable por decantación.
En un efluente de aguas residuales urbanas, el nitrógeno se presenta principalmente como nitrógeno orgánico o amoniacal (20% de la DBO5) y, en una proporción muy inferior, nitritos y nitratos. En los dos primeros casos, para su eliminación, el nitrógeno reducido se convierte en nitrito (nitrificación) y, posteriormente, en nitrato, todo ello en presencia de oxígeno. Mediante una reacción de descomposición anaerobia de la materia orgánica (desnitrificación), en la que se toma el oxígeno de los nitratos, se produce nitrógeno gas, que es eliminado, y un fango que sedimenta con alta proporción de materia orgánica oxidada.
Recientemente, el Servicio de Investigación Agrícola del Departamento de Agricultura de EEUU estudia el denominado proceso anammox (oxidación anaerobia del amonio), basado en la acción de bacterias anaerobias que descomponen el amoníaco y los nitratos, una vez estas especies ya se han formado en el efluente residual.
Cabe también destacar la aplicación de zeolitas en la eliminación de contaminantes como el amonio en aguas residuales por efecto de adsorción, que se ha ido estudiando y desarrollando durante los últimos 15-20 años2 . Al igual que en el proceso anterior, se trata de eliminar de la corriente de agua residual la especie una vez ya formada.
Técnica aplicada en el presente trabajo
Aprovechando el hecho de que la reacción de hidrólisis enzimática de la urea está asociada a una reacción de reducción, y que en el trabajo anterior ya se obtuvieron resultados positivos con el empleo de reactivos oxidantes, en el presente trabajo se ha decidido saturar el medio de reacción de oxígeno disuelto, con el fin de aumentar su capacidad oxidante del medio y así provocar la inhibición de la reacción de descomposición de la urea, evitando de forma indirecta la presencia de NH4+ en el agua residual. Para provocar la saturación de oxígeno disuelto en el líquido ensayado, la técnica más sencilla es forzar su borboteo en el seno de la disolución. Como emplear oxígeno puro es muy caro y haría inviable la aplicación de este tratamiento a escala industrial, se ha decidido borbotear aire procedente de un compresor eléctrico.
Experimentación
Metodología de preparación de experimentos y toma de muestras
Cada experimento se ha preparado tomando un muestra de 25 mL de micción diluida al 10 % en agua (que es una concentración similar a la del circuito real) en matraces Erlenmeyer de 500 mL.
La toma de muestra para el análisis de NH4+ se ha realizado cinco veces en cada experimento, primeramente en el instante de inicio y a continuación cada 24 horas durante cinco días. Se ha trabajado con estos tiempos para tener una información lo suficientemente amplia de la evolución del proceso. En cada muestreo se separan 25 mL de disolución del medio ensayado y se mide el pH con papel indicador universal, y a continuación el NH4+ con un electrodo selectivo especialmente diseñado para medir la concentración de amonio (ver apartado siguiente).
Medida de la concentración de NH4+
La medida del NH4+ requiere que junto al electrodo selectivo de amonio se utilice también un electrodo de referencia, que debe estar lleno de solución Al2(SO4)3 0,9 M. Asimismo, hay que añadir 0,5 mL de la disolución de sulfato de aluminio a cada muestra (de 20 mL) previamente a la media electródica. El objeto de añadir la solución de Al2(SO4)3 0,9 M es la regulación de la fuerza iónica del medio.
El electrodo selectivo de NH4+ actúa por medida de potencial de electrodo formado por la interacción entre la concentración de OH–en la muestra y su concentración interna de iones hidroxilo. El electrodo se puede utilizar con concentraciones del rango comprendido entre 0,02 y 1.800 ppm de concentración de NH4+. El rango de temperaturas de medida es entre 0 y 50 ºC, y el rango de pH entre 4 y 7.
Condiciones de operación en los experimentos
Los experimentos realizados han pretendido emular las posibles condiciones de las conducciones de aguas residuales industriales y de la arqueta de toma de muestras.
1. Temperatura: Entendiendo que la temperatura varía a lo largo del día, se han realizado experimentos a 25 ºC y a 30 ºC. La calefacción se ha efectuado de forma indirecta, sumergiendo el matraz en un recipiente con agua calentado por una placa eléctrica. La regulación de la temperatura se ha verificado con un termómetro de contacto.
2. Ausencia de luz: Para lograr tener las mismas condiciones de oscuridad que en las conducciones subterráneas y en la arqueta, se han envuelto todos los matraces con papel de aluminio.
3. pH: Se ha controlado el pH de los medios de forma que no se saliera de los límites de funcionamiento del electrodo selectivo, es decir, entre 4 y 7.
4. Agitación: Debido a que la recogida de las muestras reales se realiza en una arqueta sifónica donde hay movimiento de aguas, la agitación se ha conseguido por el giro entre 150 y 180 rpm de una barra magnética sumergida en el medio.
5. Borboteo de aire: Para aumentar la capacidad oxidante del medio, con el fin de inhibir la reacción de descomposición de la urea, se ha introducido en el matraz un tubo de vidrio capilar sumergido en el líquido, unido a un tubo de goma que se ha acoplado a una llave de salida de una línea de aire a presión, procedente de un compresor eléctrico.
Resultados experimentales
Calibrado del electrodo
Para el calibrado del electrodo selectivo de NH4+ se han preparado unos patrones con los que poder comparar los resultados para obtener conclusiones. Estos patrones se han realizado mediante soluciones de NH4Cl, de 10, 20, 50, 100, 200, 300, 400 y 500 ppm de NH4+ equivalente, con los que se ha confeccionado la recta de calibrado, siguiendo las mismas condiciones de preparación y medida ya descritas en el apartado 5.2.
La figura 2 muestra la recta de calibrado del electrodo selectivo de NH4+, obtenida con tres series de medidas de la concentración de amonio en los patrones preparados, cuyas concentraciones se han indicado en el apartado 5.4. La relación entre el potencial medido por el electrodo y la concentración de NH4+ sigue una función exponencial, pero si se trabaja con el logaritmo de la concentración, en ese caso la relación es lineal, tal y como se puede ver en la figura 2. Se puede apreciar cómo la correlación es muy cercana a la unidad, por lo que se han aceptado los resultados de la operación de calibrado del electrodo.
El calibrado del electrodo selectivo de NH4+ ha permitido realizar muy rápidamente cada una de las medidas para el seguimiento de la dinámica del proceso de formación de NH4+ en las aguas residuales y del efecto del tratamiento para su eliminación.
Seguimiento del proceso de formación de amonio sin tratamiento
En la primera fase de la experimentación hay que verificar la formación del amonio por la descomposición de la urea, según los procesos indicados en el apartado 3. Se han realizado 4 series de experimentos, duplicando los ensayos a 25 ºC y a 30 ºC, en los que no se ha aplicado ningún tratamiento, para no limitar la formación de amonio. En la figura 3 se puede ver el incremento de la concentración de NH4+ en las muestras que se van tomando diariamente. Asimismo, también puede observarse claramente cómo la concentración de amonio formado es mayor en los experimentos realizados a 30 ºC respecto a los realizados a 25 ºC. Esto es coherente con el hecho de que, dentro de un rango de temperaturas inferior a unos 70-80 ºC, las reacciones enzimáticas se producen con mayor velocidad al aumentar la temperatura del medio, y como ya se ha indicado, el NH4+ es producto de una reacción de hidrólisis enzimática.
Seguimiento del proceso con tratamiento de aireación
En la segunda fase del trabajo se ha hecho borbotear aire procedente del compresor a todos los medios experimentados, con el fin de inhibir la hidrólisis enzimática de la urea por efecto del oxígeno como oxidante o aplicando aire comprimido a las muestras. Aquí también se han realizado cuatro series de experimentos, dos series a cada una de las dos temperaturas ensayadas.
La figura 4 muesta los resultados ob tenidos durante los cinco días que ha durado el experimento. Puede verse cómo la concentración de NH4+ ha descendido paulatinamente con el paso de los días, incluso por debajo del valor inicial. Este hecho es muy relevante, y demuestra que la aplicación de aire al medio ha sido eficaz como tratamiento inhibidor de la reacción de descomposición de la urea. Cabe destacar que en la gráfica se ve un punto que se desvía del comportamiento general, correspondiente a la segunda muestra de una de las series realizadas a 25 ºC, pero al ser un caso aislado se deduce que puede eliminarse del resto de resultados, y que es debido a un factor aleatorio.
También es destacable que en estas series de experimentos no se observan diferencias muy apreciables de concentración de amonio entre las muestras de los experimentos realizados a 30 ºC respecto a los realizados a 25 ºC, lo que indica que la oxigenación del medio es el factor que controla la velocidad del proceso de inhibición de la reacción que forma el NH4+.
Durante todas las series de experimentos se ha podido comprobar cómo el pH del medio no varía sensiblemente con el paso de los días, lo que indica que las reacciones que tienen lugar no afectan excesivamente a la concentración de H3O+ en el medio.
Conclusiones
Se puede concluir que los resultados obtenidos son satisfactorios por cuanto se ha conseguido el objetivo perseguido: evitar la formación de NH4+ en los medios experimentados que han simulado la composición de aguas residuales sanitarias. De alguna forma, se puede considerar que los resultados incluso han superado las expectativas, ya que se ha conseguido no sólo eliminar el amonio que se forma por la degradación de la urea, sino la reducción del NH4+ que había inicialmente, manteniéndose estable el pH.
Ahora bien, precisamente la reducción tan notable de la concentración de amonio hace considerar que puede existir más
de un mecanismo por el que disminuya la concentración del NH4+ de la disolución, como puede ser el arrastre físico en un fenómeno de desorción. De coexistir ambos mecanismos, no se puede discernir directamente, a partir de los resultados obtenidos, la contribución de cada uno en la eliminación o la “no formación” de NH4+ en el efluente residual.
Puede profundizarse más en este estudio si se programa un futuro trabajo en el que se compare el efecto del borboteo de aire en las disoluciones con respecto al del borboteo de un gas inerte, como por ejemplo el nitrógeno puro. También será conveniente cuantificar mediante un caudalímetro para gases la cantidad de aire u otro gas que se hace pasar por las disolución durante cada experimento.
De cualquier forma, lo que es innegable es la eficacia del tratamiento utilizado en la eliminación de las aguas residuales de un contaminante tóxico como es el NH4+. Esto permite considerar, al menos técnicamente, la posibilidad de aplicar este tratamiento a un caso práctico a escala industrial. En el apartado siguiente se desarrolla esta idea como conclusión final.
Proyección de la investigación a una aplicación real
Para aplicar la técnica de aireación ensayada en el laboratorio a un caso práctico de la industria, se necesitaría una instalación con un compresor de aire y tuberías para su conducción hasta el seno de la aguas residuales.
El punto más oportuno de la conducción para aplicar el borboteo es la pro-pia arqueta sifónica, por tener mayor volumen que las tuberías y por tanto mayor capacidad de asumir las descargas de aire, y además por ser el elemento de la conducción con mayor tiempo de retención de las aguas residuales. La figura 5 da una idea del esquema de la instalación propuesta.
El compresor debería tener un sistema para la programación de su funcionamiento de forma intermitente, ya que a escala industrial un borboteo continuo sería excesivo, y así se evitaría provocar sobrepresiones interiores.
Bibliografía
J. L. Bueno, H. Sastre y A. G. Lavín. Contaminación e Ingeniería Ambiental, FICYT, Oviedo (1997).
M. Alexander. Biodegradation and Bioremediation. Academic Press. London. 2.ª ed. (1999).
Reglamento Metropolitano de vertidos de aguas residuales; BOPB N.º 142 del 14.6.04.
R.E. Speece, Anaerobic biotechnology for industrial wastewaters. 1996.
internet
www.quiminet.com.mx
www.mtas.es
www.chem-world.com
Referencias
1. A. Peña, M. Rueda, S. Carreras, R. Oliver y F. Estrany. Eliminación del nitrógeno amoniacal en aguas residuales sanitarias, Revista Ingeniería Química, 420. (2005). Págs. 161- 168.
2. F. A. Munpton. Natural Zeolites. In Zeo-Agriculture. Use of Natural Zeolites in Agriculture. Westview Press. Boulder, Colorado. EEUU. (1984). pp. 33-34.