Recuperación de la plata de las radiografías
Diversos métodos analíticos y galvánicos permiten recuperar la plata de las radiografías médicas para evitar la contaminación del medio ambiente
Al observar una película radiográfica se ve aparentemente dos zonas diferenciadas: una negra y una blanca. La negra constituye la zona que ha recibido la luz constituida por un conjunto de átomos de plata alrededor de cada uno de los átomos de plata iniciales, debido a la acción de una sustancia química reductora que cede electrones a los haluros de plata durante el revelado. El bromuro de plata reacciona según:
AgX + e-? Ag + X–
La sustancia química reductora es un compuesto aromático del tipo del polifenol (por ejemplo, la hidroquinona). La zona blanca se originada por la acción de productos químicos que actúan sobre el haluro de plata que no se ha expuesto a la luz. Estas zonas y sus matices se muestran en la figura 1.
Estas zonas son la información que capta la película, que permite determinar las lesiones presentes en los pacientes sometidos a la acción de los rayos X.
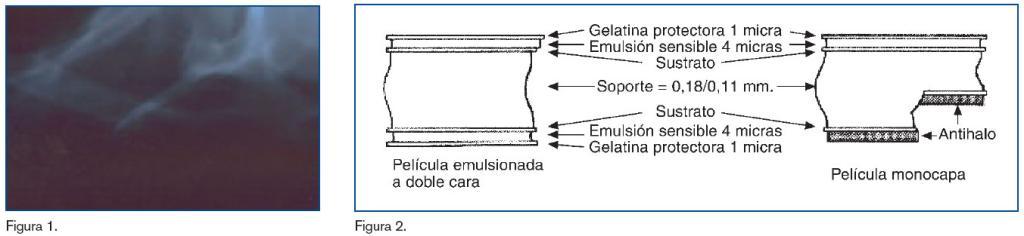
La película está compuesta por cuatro zonas diferenciadas (figura 2). Una primera zona llamada emulsión sensible a la radiación X, extendida por una sola o por ambas caras de la película. Esta capa está constituida por una finísima suspensión de microcristales de halogenuros (cloruros, bromuros y yoduros) de plata en gelatina. La combinación de estos constituirá la zona sensible a la radiación X. 
La zona central es el soporte o lámina de plástico de gran resistencia mecánica, de color azulado y con cierta rigidez.
La perfecta cohesión entre las capas de emulsión y el soporte se consigue mediante un tratamiento químico que constituye la zona llamada sustrato.
Sobre la emulsión hay un delgado recubrimiento de gelatina endurecido, que actúa como protector de la delicada superficie de la emulsión contra las abrasiones y rozamientos.
La recuperación de la plata es de vital importancia desde el punto de vista medioambiental, como lo es de otros metales y compuestos (Hg por ejemplo).
Proceso fotográfico
Desde que la película virgen recibe la imagen que le envían las pantallas de refuerzo, hasta que la imagen final está lista, debe de padecer un complejo proceso, inicialmente en el interior de la propia emulsión y final-mente, exteriormente, con el revelado.
La emulsión en estado virgen tiene unos cristales de halogenuro de plata de forma triangular a hexagonal y de tamaños muy heterogéneos, dispersos en la gelatina. Esta heterogeneidad da a las emulsiones su efecto contrastante y la posibilidad de dar una extensa gama de grises.
Cuando recibe la exposición, la radiación produce una alteración en los cristales consecuencia de unos procesos electrónicos donde se produce una excitación de un electrón desde la banda de valencia hasta la banda de conducción del bromuro de plata (banda GAP = 2.7eV) desencadenando un proceso que genera cristales de Ag.
AgBr (s) + Fotones ? Ag (s) + Br –(aq)
Con pequeñas intensidades de radiación, se alteran únicamente los cristales más grandes, porque por su mayor área proyectiva tiene mayor probabilidad de capturar fotones.
Realmente, en este momento se ha formado una imagen en la emulsión. Se constituye en cada punto de la película unos cristales alterados en número proporcional a la cantidad de radiación recibida localmente. Esta imagen, se llama imagen latente, es estable y permanente, pero resulta inapreciable a la vista.
Para obtener la imagen definitiva se ha de aplicar el proceso de reveladofijado. En el revelado se transforman los cristales irradiados y alterados, en plata metálica finamente dividida de color negro, mediante productos como la hidroquinona, metol, etc., que lo que hacen es oxidarse y producir la reducción de la plata, ennegreciéndola.
Los cristales no irradiados no padecen modificación, sino que se ven afectados por el fijador que elimina los cristales de halogenuro de plata que no han reaccionado con la radiación. Este proceso se llama fijación.
De esta forma según sea la penetración de la radiación se distinguirán las dos zonas indicadas en la introducción de este artículo, una blanca (zona de nopenetración) y otra negra (zona de penetración), con sus correspondientes matices.
Técnica experimental
Disolución de las radiografías
Las radiografías una vez trituradas a unas dimensiones medias de 1 cm2 (figura 3) se disuelve con ácido nítrico, reactivo que en comparación con otros da una mayor eficacia, probado con la adición de unas gotas de cromato potásico, que reacciona con los cationes de plata disueltos, formándose un precipitado de color rojo de cromato de plata.
2Ag+ (aq) + CrO42– (aq) ? Ag2CrO4 (s)
En la reacción con el ácido nítrico las radiografías se decoloran y forman una disolución previa filtración de color amarillo (figura 4) correspondiendo a la forma líquida del nitrato de plata. 
En la disolución es muy importante el proceso anterior. La filtración y previa limpieza de las radiografías atacadas con agua destilada determina el nivel de pérdidas de plata disuelta en el proceso. La realidad es que existen pérdidas en este sentido, porque resulta muy difícil limpiar perfectamente, sin una ayuda mecánica exterior, toda la superficie de las radiografías.
Descripción de la reacción de disolución de las radiografías
La reacción de disolución de las radiografías se produce sobre la emulsión. El ácido nítrico destruye la emulsión, disuelve la gelatina que la constituye y se lleva los átomos de plata hacia la disolución.
La reacción con la plata se describe como 4Ag (s) + 6HNO3 (aq) ? 4AgNO3 (l) + NO (g) + NO2 (g) + 3H2O (l), donde se produce un desprendimiento de gases incrementado por la acción de la temperatura.
La reacción de disolución está influenciada proporcionalmente con la masa de plata disuelta con la concentración de plata, agitación y temperatura. Por concentración oscila entre el 1% de plata para el ácido al 60% y el 0,75% para el ácido al 1%.
El valor práctico cuantitativo de la concentración de plata está sujeto al estado de las radiografías. Para determinar la concentración se usa el Método Volhard. Éste es un método analítico de argentometría que realiza la titulación de la plata con una solución patrón de ión tiocianato potásico.
Ag+ (aq) + SCN–(aq) ? AgSCN (s)
Se utiliza como indicador un compuesto químico que contenga el catión Fe3+, para que en el punto de equilibrio reaccione toda la plata en forma de tiocianato de plata, se forme un complejo de color rojo Fe(SCN)2+ llamado Monotiocianatoferrato (III) con un ligero exceso de ión tiocianato (figura5).
El proceso se deberá realizar en medio ácido, pero dentro de unos límites no muy exagerados (0,5-1,5), porque el complejo se degrada por debajo de este pH, neutralizando con hidróxido sódico. Si el pH fuera básico se formaría un precipitado de color naranja, el trihidroxoferrato (III), que se comienza a formar a un pH alrededor de 6.
El indicador seleccionado es el sulfato férrico amoniacal con una concentración en peso del 40%. El cambio de color aparece un 1% antes del punto de equivalencia porque el tiocianato de plata adsorbe iones plata. Por lo tanto, llegado el punto final se debe continuar la titulación con agitación vigorosa hasta que el color anaranjado no desaparezca.
La cantidad de plata se obtiene según la estequiometría 1:1 de la reacción: Ag+
+ SCN–? AgSCN(s)
Se obtiene como termino medio un 0,95% de plata contenida en la radiografía (concentración ácido nítrico 10%).
Formación de complejos para el uso en los tratamientos específicos de la recuperación de la plata
La plata se encuentra en medio ácido y en forma de nitrato de plata. Para mejorar el proceso posterior de recuperación se forman dos compuestos complejados con la plata, porque de estos, la recuperación de la plata es más efectiva.
Inicialmente se considera la formación del complejo con el tiosulfato sódico. El complejo ditiosulfatoargentato (I) se forma a partir del cloruro de plata y un exceso de tiosulfato sódico.
El segundo de los complejos es el diaminoargentato (I) formado a partir de una sal insoluble como el cloruro de plata con un gran exceso de amoniaco en medio acuoso.
Descripción de los complejos
a) Complejo ditiosulfatoargentato (I)
Introductoriamente comentar la estabilidad del tiosulfato sódico depende del pH de la solución, de la presencia de microorganismos, la concentración de la solución, la presencia de iones cobre (II) y la exposición a la luz del sol. Esto produce una variación porcentual de su composición.
La velocidad de reacción de descomposición aumenta claramente a medida que la solución se vuelve ácida. En este caso, de forma inmediata se descompone en forma de azufre y bióxido de azufre (color amarillo-canario).
S2O32– (aq) + 2H+ (aq) ? SO2 (g) + S (s) + H2O (l)
En el caso de las soluciones neutras o ligeramente alcalinas son ciertas bacterias que metabolizan el tiosulfato a iones sulfito.
S2O32– (aq) + H2O (l) ? SO42– (aq) + S2– (aq) + 2H+ (aq)
Esta actividad parece mínima a un pH entre 9-10, lo cual explica la mejora de la estabilidad. La presencia de bactericidas como cloroformo, benzoato de sodio o ioduro de mercurio (I) pueden también retardar la descomposición.
La formación del complejo se efectúa superando la problemática de su estabilidad con la formación de haluros de plata. Se selecciona el cloruro sódico que forma el cloruro de plata, que finalmente reaccionará con el tiosulfato de sódico formándose el complejo.
AgCl (aq) + 2 Na2S2O3 (aq) ? Na3[Ag(S2O3)2] (aq) + NaCl (aq)
Antes de ejecutar la operación se debe extraer el líquido sobrante de la reacción con el cloruro sódico, con pipeta y pera, dejando precipitar todas las partículas de cloruro de plata durante unas horas. En este momento los restos no extraíbles se neutralizan con acetato sódico hasta pH 7,5, para evitar que en la posterior adición del tiosulfato sódico, éste se degrade.
Para calcular la cantidad de cloruro sódico necesario para precipitar toda la plata presente en la disolución, se usa el valor obtenido por el Método Volhard donde se determina que para un ácido nítrico al 10% en una muestra de 1,5 gramos de radiografías hay 0,0142 gramos de plata a tiempo de reacción completo (90 minutos). Por lo indicado, el porcentaje de plata por unidad de radiografía es del 0,947%.
Experimentalmente el ataque se hace con 100 gramos de radiografías y 300 ml de ácido nítrico al 10%. Esto significa que existirán en la muestra 0,947 gramos de plata.
Para 0,947 gramos de plata son necesarios 0,513 gramos de cloruro sódico para formar el cloruro de plata.
Para determinar la cantidad de ditiosulfatoargentato (I) que se forma a partir de 1,257 g AgCl, se hacen los cálculos a partir de las constantes de formación y solubilidad de las especies participantes.
Resultan 3,232 g Na3[Ag(S2O3)2].
b) Complejo diaminoargentato (I)
El complejo diaminoargentato (I) se forma mediante el aprovechamiento del cloruro de plata utilizado para formar el complejo ditiosulfatoargento (I), para adicionarle de forma cualitativa amoníaco al 30% (poca cantidad) en dilución con agua destilada, y mejorando las condiciones de reacción aumentando la temperatura.
El complejo diaminoargentato también se forma mediante la reacción de amoníaco acuosa con óxido de plata.
Métodos experimentales para conseguir plata
Los métodos básicos para obtener plata practicados son:
a) Precipitación.
b) Sustitución metálica o reacción galvánica.
El método de precipitación se basa en la reacción de tres compuestos insolubles con diferentes componentes reductores. Estos tres son el óxido de plata, el sulfuro de plata y el cloruro de plata.
El método de sustitución metálica se basa en la reacción de un metal más noble que la plata para que ésta sustituya a la plata del compuesto complejado que la acoge. Esta práctica recae sobre el complejo de tiosulfato. Existe una variante del proceso que se basa en la reducción de la plata catiónica del nitrato de plata.
Método de precipitación
El método de precipitación se basa en la interacción de distintas moléculas que su producto es una especie insoluble. Luego el precipitado se filtra y se procede en distintas direcciones.
Los problemas que plantea este método son la baja selectividad hacia los compuestos que la hacen precipitar, el elevado coste que tiene esta operación, la generación de gases potencialmente tóxicos y la difícil filtración.
Obtención de plata a partir del óxido de plata
La vía del Ag2O se basa en la precipitación de esta especie, mediante la adición de hidróxido sódico, a la solución del ataque de las radiografías, aumentando el pH hasta un valor óptimo comprendido entre 8,5 y 11.
2Ag+ (aq) + 2NaOH (aq) ? Ag2O (s) + H2O (l)
La extracción del óxido precipitado se realiza por filtración con papel de filtro pese a las pequeñas pérdidas de óxido.
Posteriormente la masa de óxido de plata se seca en el horno para ser tratado con un agente reductor como un aldehído (el aldehído se convierte en un ácido carboxílico).
La reacción se realiza con formaldehído en una disolución de óxido de plata con agua destilada con una lana de vidrio que actúa como catalizador, porque da una mayor superficie de contacto entre reactivos.
HCHO (aq) + Ag2O (s) ? Ag (s) + HCOOH (aq)
Se deja reaccionar y el producto de la reacción es un precipitado de color gris, que es plata impura (figura 6).
Una segunda variante es la formación del complejo diaminoargentato (I) con el óxido de plata, que posteriormente, como sucede en la Prueba Tollens, reacciona con un aldehído, reduciéndose a plata metálica.
Ag2O (s) +4NH3 (l) +H2O (l) ? 2Ag(NH3)2 + (aq) + 2OH–(aq)
HCHO (aq) + Ag(NH3)2 + (aq) ? Ag (s) + HCOOH (aq)
El Ag(NH3)2 + es un oxidante muy débil que reacciona lentamente depositándose la plata metálica en las paredes del recipiente cuando éstas están limpias como un espejo, y si no se forma un precipitado de color negro o gris, difícil de filtrar.
Obtención de plata a partir del sulfuro de plata
Para precipitar el sulfuro de plata se utilizan metales alcalinos de sulfuros como por ejemplo el sulfuro de sodio o el sulfuro de potasio. Luego el sulfuro de plata que se forma se recupera mediante una filtración.
Este método tiene una serie de desventajas. La falta de aceptación del proceso de filtración del sulfuro de plata puede ser atribuida primariamente a dos factores:
a) La adición exagerada de X2S puede generar la formación de H2S, compuesto tóxico. Esta reacción se produce cuando reacciona el sulfuro de sodio con agua, produciéndose ácido sulfhídrico (X = Metal alcalino).
Na2S (aq) + 2H2O (l) ? H2S (g) + 2NaOH (aq)
El Ag2S es difícil de filtrar, porque tiene un tamaño de partícula muy pequeño.
b) Experimentalmente se utiliza la disolución resultante del ataque de las radiografías, donde hay cationes plata que reaccionan con sulfuro de sodio, para obtener el sulfuro de plata de color negro.
Na2S (aq) + Ag+ (aq) ? Ag2S (s) + Na+ (aq)
En este punto del proceso en algunas zonas de la masa precipitada de sulfuro de plata aparece plata metálica. Para reducir el sulfuro se hace reaccionar éste con acetaldehído utilizando lana de vidrio para mejorar el contacto entre los dos compuestos. Este proceso genera plata metálica como se ve en la figura 7.
Obtención de plata a partir del cloruro de plata
La reacción para reducir el cloruro de plata a plata metálica se hace también por medio de un agente reductor, que a su vez es un agente usado en el revelado fotográfico.
La hidroquinona es eficaz actuando como agente reductor para las disoluciones de cloruro de plata solamente cuando se utiliza en soluciones alcalinas. El agente reductor activo es el ión bivalente, y cuando aumenta el pH de la solución se explica por la concentración de este ión.
Experimentalmente el que 1,4-benzenodiol (hidroquinona) se oxida a la correspondiente dicetona-2,5-ciclohexadieno-1,4diona (p-benzoquinona) por acción de un oxidante como el dicromato sódico en medio básico, produciéndose una secuencia de transferencia de protón y electrón (figura 8).
El mecanismo experimental se inicia con la solución del ataque de las radiografías, posterior adición de cloruro sódico y filtrando el cloruro de plata resultante. El cloruro de plata se basifica con sulfito sódico a pH 7,5-8 y a continuación se adiciona la hidroquinona.
La solución inicial del cloruro es blanca pero en adicionar el dicromato de sodio la solución se vuelve verde. Este verde con el tiempo se vuelve más oscuro. La generación de plata no es inmediata y aparece como un precipitado gris que cada vez es más brillante.
Método de sustitución metálica
La sustitución metálica se basa en la sustitución de la plata adyacente en un compuesto por otro metal más activo. La efectividad del método radica en que el metal tenga un menor potencial estándar que la plata para poder reducir sus iones metálicos de potencial estándar mayor.
El proceso de sustitución metálica presenta por ventajas su coste bajo de operación y la simplicidad de la instalación y por desventajas la dificultad para saber el momento en que se debe adicionar el hierro y la suciedad que genera el proceso. 
Características del proceso
El proceso de sustitución metálica se compone por dos procesos electroquímicos espontáneos o galvánicos de donación y aceptación de electrones. La aceptación y la donación son producto de la transferencia de electrones que puede ir acompañada de otros procesos, como la transferencia de un átomo o de un ión.
La plata es la especie que se reduce y que se transforma en dos tipos de especies químicas, para los dos procesos desarrollados.
- –
- La primera es la forma complejada del ditiosulfatoargentato (I) cuyo potencial de reducción a plata metálica es de 0.017 Voltios. El metal sustituidor ha de tener un potencial de reducción inferior que el del complejo. Se selecciona el hierro, cuyo potencial de reducción es de –0,44 Voltios. Se podrían escoger otros, como el zinc o el aluminio, pero por razones eficiencia económica se usa el hierro.
- –
- La segunda es la plata catiónica contenida en la solución del ataque de las radiografías. Para este caso el potencial de reducción de la plata es 0,7996 voltios. El metal seleccionado es el cobre cuyo potencial de reducción es 0,3502 voltios.
En ambos casos la suma de potenciales es positiva, por tanto espontánea es la reacción electroquímica, y los valores de los potenciales se establecen como es lógico en condiciones estándar de temperatura y presión, y concentración molar igual a uno.
En términos termodinámicos, el proceso de reducción produce una disminución de la energía libre al pasar del estado metálico al estado oxidado. Esto produce un fenómeno químico llamado electrodeposición.
Si se analiza microscópicamente la superficie del metal de potencial estándar menor se puede ver cómo los iones Ag+ padecen una electronización formándose plata metálica sobre el metal que se están depositando. La reacción está limitada por la difusión de los iones Ag+, aumentando la velocidad de reacción con la agitación y la superficie de metal sustituidor.
Descripción del proceso
Para conocer el momento de sustitución o momento de iniciación de la reacción se deben considerar una serie de factores.
a) Control del pH.
El pH determina las interacciones producidas entre las diferentes especies presentes y el hierro. Para el buen funcionamiento es imprescindible que el pH esté entre 4-6,5 y encontrar el pH óptimo de 5,6 dentro del intervalo para maximizar el rendimiento de la reacción. Para pH inferiores a 4 el hierro se disuelve con ácido formándose óxido de hierro y para pH superiores a 6,5 la reacción de sustitución es más lenta y se pierde plata.
Para aumentar el pH de la solución del complejo se utiliza acetato de sodio y para reducirlo se usa el ácido acético.
b) Superficie del hierro.
La superficie del hierro se aumenta utilizando lana de hierro, porque ésta es un conjunto de filamentos que disponen de una alta superficie específica para el buen contacto entre reactivos (figura 9).
c) Concentración de complejo.
La concentración de complejo determina la cantidad final de plata recuperada.
Variantes del proceso
a) Las reacciones electroquímicas del proceso de reducción de la plata complejada del complejo ditiosulfatoargentato (I) y la oxidación del hierro son:
Para este proceso se obtiene como producto plata metálica muy brillante y aparentemente pura que queda adherida en la superficie del vaso de precipitados (figura 10). Esta plata se puede recuperar frotando con un instrumento adecuado. El hierro que ha padecido la oxidación se queda de color negro, con zonas de color rojo-marrón correspondientes a óxidos de hierro.
b) Para el proceso con plata catiónica disuelta en la disolución resultante del ataque de las radiografías, con un filamento de cobre produce una plata de color gris oscuro (figura 11).
El color gris oscurecido se debe a que la plata no debe ser completamente pura y presenta ciertas impurezas.
Para esta reacción se ha determinado el rendimiento no considerando las posibles pérdidas como el cociente entre el valor teórico de plata de 0,0752 g, suponiendo un 0,94% de plata en las radiografías y el valor experimental de 0,067 gramos. El rendimiento es del 89,1%. 
Conclusiones
Los estudios iniciales con el Método Volhard permiten establecer que en un gramo de radiografía hay por termino medio un 0,95% de plata. Este valor esta determinado por las condiciones del ácido nítrico utilizado, en función de su concentración, temperatura o agitación durante la reacción.
De los métodos el más efectivo es el proceso de sustitución metálica porque permite recuperar plata de mayor pureza pese a las dificultades operacionales de la reacción.
Para la primera variante con el complejo ditiosulfatoargentato (I) por sustitución metálica la plata conseguida es de gran pureza y fácil extracción, en cambio, con la variante de plata catiónica permite conseguir plata con mayor efectividad.
El método de precipitación presenta la dificultad unívoca de obtener un producto final muy impurificado de bajo rendimiento operacional. Es imprescindible un proceso posterior de purificación.
Agradecimientos
Los autores agradecen a los Sres. Salvador De Mata y Joaquín Sarzoso de la empresa “Mateu & Sole, S.A.”, la ayuda prestada en la fase del molturado mecánico de las radiografías, y al Hospital de Granollers la cesión de dichas radiografías.
Bibliografía
- V. Almagro. TEORÍA Y PRÁCTICA DE ELECTRO-ANÁLISIS. Primera edición. Editorial Alhambra S.A. Madrid. 1969.
- A. Charlot. J. Badoz, B. Tremillon. LAS REACCIONES ELECTROQUÍMICAS. Editorial Toray-Masson. Barcelona. 1969.
- Cesar S. Redusa, Rafael Casanovas. DIAGNÓS-TICO POR IMAGEN. COMPENDIO DE RADIOLO-GÍA CLÍNICA. Editorial Interamericana. Mc. Graw-Hill. Madrid. 1987.
- M. Martínez Morillo. APUNTES DE RADIOLOGIA Y MEDICINA FÍSICA I.. Bellaterra. Facultad de Medicina. 1979
- J.W. Dilleen, S.D. Sprules, B. J. Birch I B.G. D. Haggett. Electrochemical determination of silver in photographic solutions using fixed-volume single-us sensors. THE ANALYST. THE ROYAL SOCIETY OF CHEMISTRY. Nº 123. 1998.
- A.J. Dole, T.J. Cardwell, R.W. Cattrall, R. Di Giacomo, C.B Rodríquez I G.R. Scollary. The determination of Silver in Photographic Emulsions by Discontinuous Flou Analysis. THE ANALYST. THE ROYAL SOCIETY OF CHEMISTRY. Nº 1. 1997.
- Keith B. Oldham y Jan C. Myland. FUNDAMENTS OF ELECTROCHEMICAL SCIENCE. Academic Pres. San Diego. 1994.
- Keith Scott. ELECTROCHEMICAL PROCESSES FOR CLEAN TECHNOLOGY. Departament of chemical and Process Engineering University of Newcastle. 1995.
- A. Skoog, Donald N. West, J. Holler. FUNDAMENTOS QUÍMICA ANALÍTICA. Sexta edición. Ed. Mc. Graw-Hill. 1997.
- F. Burriel. QUÍMICA ANALÍTICA CUALITATIVA. Ed. Paraninfo. Madrid. 1994.